本篇目录:
简单离子半径比较方法
1、离子半径比较 同种元素的粒子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例如:r(Cl-)r(Cl),r(Fe) r(Fe2+)r(Fe3+)电子层结构相同的离子,核电荷数越大,半径越小。
2、方法如下:电子层数越多,半径越大。电子在原子核外按层排布,类似于洋葱,皮的层数越多,洋葱的半径自然就越大;如果电子层数相同,则比较核电荷数,核电荷数越多,半径越小。
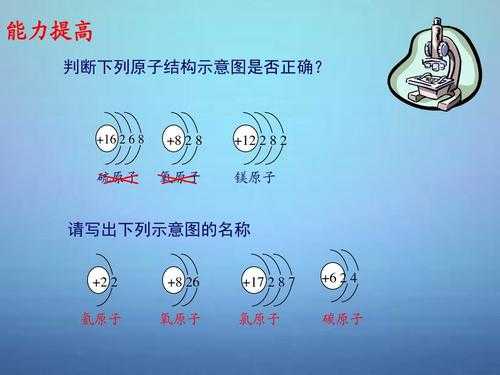
3、离子半径大小的比较方法如下:电子层数相同时,看电子数,电子数越多,半径越大。电子层数相同且电子数相同时,看核电荷数,核电荷数越少,半径越大。
4、比较离子半径大小的方法:电子层数。电子层数多,半径大。可以这样理解,电子在原子核外按层排布,类似于洋葱,皮(层)多,洋葱(原子)的半径自然就大。如果电子层数相同,则比较核电荷数,核电荷多,则半径小。
5、离子半径越大。如:钾离子的离子半径大于钠离子的半径。硫离子的半径大于氧离子的半径。电子层数相同的离子半径的比较:质子数越大,离子半径越小。如:氧离子、氟离子、钠离子、镁离子、铝离子的半径依次减小。
6、比较离子半径大小方法:同一周期内元素的微粒,阴离子半径大于阳离子半径。同类离子与原子半径比较相同。同一元素的微粒,电子数越多,半径越大。

元素周期表第三周期元素对应离子,谁的离子半径最小
1、非金属元素 是得电子,所以 金属离子 半径变小。
2、铝离子的离子半径最小。原因:铝原子丢掉三个电子变为铝离子,此时原子外围仅有两层电子,并且铝原子所带正电量多,可以吸引带负电的电子,故半径最小.离子半径大小的判断方法 (1)同一元素的微粒,电子数越多,半径越大。
3、第3周期离子半径最小的元素应该是氯元素。主要原因是根据化学元素周期表的规律同周期,他们指的是在同一个电子层排布电子。而随着原子序数的增加,从左到右,原子核对于核外电子的吸引力逐渐增加。就导致了半径的减少。
4、(2)同一族的元素从上到下,随电子层数增多,原子半径增大。下一周期原子半径大于上一周期原子的半径。如第三周期中半径最大的是钠原子,最小的是氯原子;第六主族中氧原子半径最小。

钠镁铝硅磷硫氯半径比较?
1、(1)同一元素的微粒,电子数越多,半径越大。如钠原子钠离子,氯原子氯离子,亚铁离子铁离子;(2)同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子锂离子;(3)同类离子与原子半径比较相同。
2、一般,电子层数越多,微粒半径越大,所以硫离子与氯离子大于钠离子和镁离子。钠离子与镁离子、硫离子与氯离子电子层结构相同,电子层结构相同时,核电荷数越小,半径越大。所以硫离子大于氯离子,钠离子大于镁离子。
3、半径 37 122 152 111 88 77 70 66 64 160 元素 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 半径 186 160 143 117 110 104 99 191 227 197 除了查表,也可推断:前二十号除了H外,越往下,越往左,原子半径越大。
氟离子,钠离子,镁离子,铝离子半径大小比较(附带说明,谢谢)
同周期的阳离子半径,从左到右,逐渐减小:钠离子镁离子铝离子。
(3)同类离子与原子半径比较相同。如钠离子镁离子铝离子,氟离子氯离子溴离子 (4)具有相同电子层结构的离子(单核),核电荷数越小,半径越大。
(2p5),共两层,而Na原子的电子排布为(1s2)(2s2)(2p6)(3s1)共三层,所以F原子比Na原子半径小;F离子与Na离子的外层电子书相同,但Na离子核电荷数为11,而F离子的核电荷数为9,所以,F离子半径比Na离子大。
离子半径越大。如:钾离子的离子半径大于钠离子的半径。硫离子的半径大于氧离子的半径。电子层数相同的离子半径的比较:质子数越大,离子半径越小。如:氧离子、氟离子、钠离子、镁离子、铝离子的半径依次减小。
电子层结构相同的,核电荷数越少的,半径越大,比如镁离子和F-,它们的离子结构示意图都是2 氟的核电荷数小,所以它的半径大于镁离子的半径。
到此,以上就是小编对于镁离子和硫原子哪个大一些的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏



