本篇目录:
- 1、硼是周期表第三主族唯一的非金属元素,B原子的价电子结构是什么...
- 2、第一电离能越大元素非金属性越强对不对?
- 3、铍和硼第一电离能
- 4、硼的第四电离能远大于第三电离吗
- 5、元素周期表中第一电离能怎么判断?
硼是周期表第三主族唯一的非金属元素,B原子的价电子结构是什么...
硼是周期表第三主族唯一的非金属元素,B原子的价电子结构是:2s22p1,它能提供成键的电子是2s2p,还有一个空轨道。
硼是周期表第三主族唯一的非金属元素,B原子的价电子结构是2s22p1,这种B原子的价电子少于价轨道数的缺电子情况,但硼与同周期的金属元素锂,铍相比原子半径小,电离能高,电负性大,以形成共价键分子为特征。
基态硼原子的电子排布式是:1s22s22p1。B是5号元素,故其基态原子的电子排布式为1s22s22p1。
硼是位于周期表中的第三主族元素,其电子排布为1s 2s 2p。由于硼原子只有三个价电子,它的原子核周围没有足够的电子来填充所有可能的共价键位置。
第一电离能越大元素非金属性越强对不对?
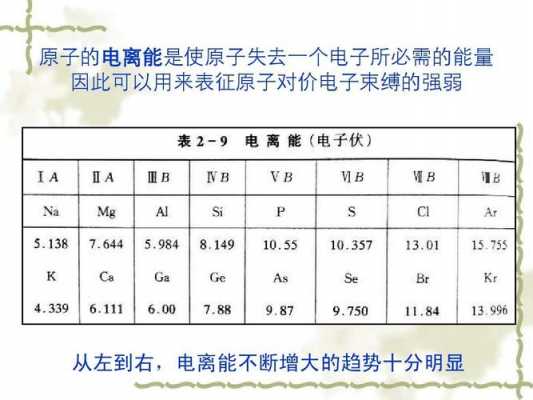
1、C 试题分析:非金属性越强,第一电离能越大。但由于氮元素的2p轨道处于半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的第一电离能,答案选C。点评:该题是高考中的常见考点,属于基础性试题的考查。
2、C 非金属性越强,第一电离能越大,氧元素的非金属性最强,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能最大的是氮元素,答案选C。
3、第一电离能大小和金属性非金属性相关,非金属性强的第一电离能越大,金属性强的第一电离能越小,但是同周期稀有气体最大,第三主族、第六主族由于全空、半充满规则会比它左边的同周期主族第一电离能小。
铍和硼第一电离能
1、电离能 对于多电子原子 , 处于基态的气态原子生成 H +气态阳离子所需要的能量, 称为第一电离势 ,常用符号 I1 表示 :M (g)——— M +(g)+e。第一电离势 =I 1(1 可省去)。
2、电离能(I)基态的气态原子失去一个电子形成气态一价正离子时所需能量称为元素的第一电离能(I1)。元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2)。
3、这意味着在锂中,最外层电子处于2s轨道中,而在铍中,最外层电子填充了1s轨道。由于2s轨道的能量较高,因此从锂到铍,电离能突然增加。
4、不一定.第一电离能同周期从左到右递增,同主族从上到下递减.大部分如此但也有例外.如:硼(B)与铍(Be)在同一主族且在铍右边。
5、主要原因是因为金属铍和金属镁的最外层电子是两个电子。也就是说他是一个s全满的结构。这样的话,通常从两个电子中要电离出一个电子所需要的能量就比较大。而金属铝它的最外层电子是三个。就不存在这个情况。
硼的第四电离能远大于第三电离吗
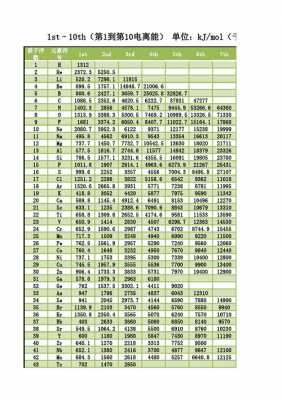
1、B,很明显ns2np4的原子第一电离能要小于p5和p6的(核电荷数小)。
2、可见确实是铍的第三电离能最大。解释如下:失去两个电子以后,Be2+的电子构型是1s2,处于全充满状态,所以难以再失去第三个电子。这个从B的第四电离能比第三电离能大得多可以得到印证。
3、根据元素电离能知,第三电离能和第四电离能相差较大,说明p元素原子失去3个电子时变为稳定结构,则p元素原子最外层有3个电子。第15号化学元素,符号P。处于元素周期表的第三周期、第ⅤA族。磷存在于人体所有细胞中。
元素周期表中第一电离能怎么判断?
第一电离能大小和金属性非金属性相关,非金属性强的第一电离能越大,金属性强的第一电离能越小,但是同周期稀有气体最大,第三主族、第六主族由于全空、半充满规则会比它左边的同周期主族第一电离能小。
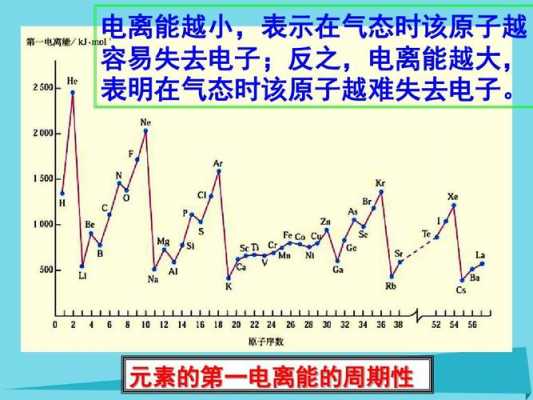
第一电离能(原子失去最外层的一个电子所需能量)数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。
第一电离能判断大小方法如下:总体上金属元素第一电离能较小非金属元素第一电离能较大。同周期元素第一电离能从左到右有增大的趋势。所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。
元素第一电离能大小顺序图:从左到右第一电离能逐渐增大,同族元素从上到下逐渐减小。在元素周期表中,元素的第一电离能从左到右呈现增大的趋势,但也有一些例外。
到此,以上就是小编对于铍和硼哪个电离能大些的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏