本篇目录:
为什么氦的电离能最高?
1、随着核电荷数的递增,元素的第一电离能呈现周期性变化。第一电离能周期性变化表 总体上金属元素第一电离能较小,非金属元素第一电离能较大。同周期元素第一电离能从左到右有增大的趋势。
2、氦原子中有两个电子,两个电子填在1s轨道,自旋相反,成为孤对电子,比较稳定;而氢原子是一个单电子,容易电离,所以氦的电离能比氢高。
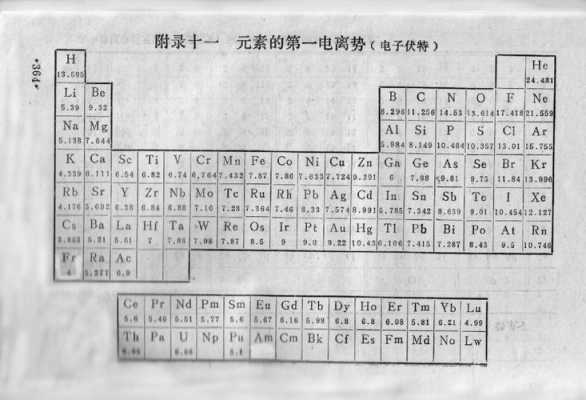
3、氦。第一电离能是指从一个原子中移除一个电子所需的能量,最大的第一电离能出现在具有最高核电荷的元素上,核电荷越高,束缚电子越紧密,需要更多的能量才能将其移除。
怎么计算第二电离能
【答案】:氦原子的第二电离能为:$He原子的总能量等于第一和第二电离能总和的负值,即-(I1+I2)=-(26+54)eV=-70eV。
第二个电子的电离能就是D2=+16*3^2。
锂电离能计算公式是,E=-16×Z-o/n 其中,Z是该原子。由物质结构理论,第一电离能,第二电离能,第三电离能。

电离能的概念:电离能(第一电离能)是从气态原子移走一个电子所需要的能量 电离能的周期性变化规律:同一周期,第一电离能从左到右依次增加;同一主族,第一电离能从上到下依次减弱。
第二电离能大小比较规律是电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强。电离 电离有化学电离和物理电离之分。化学上的电离是指电解质在水溶液或熔融状态下离解成带相反电荷并自由移动离子的一种过程。
用轨道能量和屏蔽效应说明为什么氦的电离能比氢高,但锂的电离能却比氢...
1、氦(He)的电子排布为 1s2。氦的电子所在的轨域与氢原子相同。电子离原子核近且没有屏蔽。氦的电离能 (2370 kJ mol-1) 比氢高得多,这是由于氦原子有2个质子吸引电子,而氢原子只有一个。锂(Li) 1s22s2。
2、氦(He)的电子排布为 1s2。氦的电子所在的轨域与氢原子相同。电子离原子核近且没有屏蔽。氦的电离能 (2370 kJ mol-1) 比氢高得多,这是由于氦原子有2个质子吸引电子,而氢原子只有一个。锂(Li) 1s 2s 。
3、因为屏蔽效应使核对外层电子的束缚变小,内层电子对外层电子的排斥力使其远离核,所以能量升高。外面电子对里面电子有排斥作用,推动电子更朝向原子核的方向,而就原子能级而言,E在最外层趋近0,越靠近原子核E负的越多。
到此,以上就是小编对于为什么氦的电离能比氢高,锂的电离能比氢低的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏